20 Примери киселина
Мисцелланеа / / July 04, 2021
Тхе киселине чине важну групу од хемијска једињења, веома широк. Киселине се генерално дефинишу као једињења која могу да донирају једно или више катиони водоник (Х.+) у друго једињење, познато као база. Иако се у стварности киселине дефинишу према неколико теорија:
 Ограничење ове теорије је да се киселине дефинишу само у воденом раствору.
Ограничење ове теорије је да се киселине дефинишу само у воденом раствору. 

Својство пуштања катјони водоника је оно што тера киселине да производе решења пХ мање од 7. Киселине које могу ослободити више протона (користећи ово име за Х.+) називају се полипротични или полифункционални.
Својства киселине
Што се тиче њихових својства, киселине се могу представити као течности или као гасови, ређе као чврст. Кисели укус који можемо препознати и који карактерише ова једињења налазимо, на пример, у лимунско воће, богато лимунском киселином, или сирће, које је кисели раствор сирћетна. То су органске киселине.
постоје органске и неорганске киселине; најјачи су обично они неоргански. Многе органске киселине служе важним биолошким улогама. Међу неорганским постоји једна, хлороводонична киселина, која игра веома важну улогу у процесу варења. Тхе
нуклеинске киселине Они су такође основни за живот, јер су основа генетског материјала ћелије и садрже кључ за синтезу беланчевина.Тенденција губитка протона је оно што одређује снагу киселине.
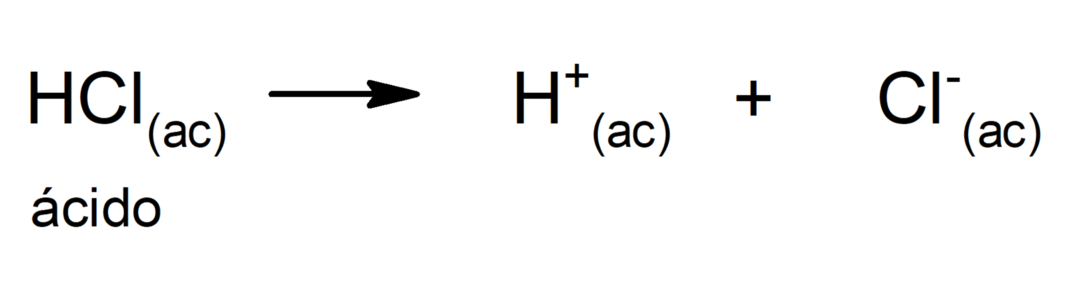

Употреба киселина
Киселине имају много употреба, како у индустријским тако и у кућним размерама. Често се користе као адитиви и конзерванси у храна, козметика, пиће итд. Неке киселе чврсте супстанце се користе као катализатори (убрзивачи хемијских реакција) у петрохемијској или папирној индустрији.
Постоје и киселине које се користе као дезинфицијенси (карболна киселина, салицилна киселина). Поред тога, могу се користити као електролити у аутомобилским акумулаторима, као што је случај са сумпорном киселином. Ова последња јака киселина се такође често користи у преради минералиТакав је случај производње ђубрива из камених фосфата.
Вреди разјаснити да се одређене супстанце могу растворити само у киселом медијуму и да се одређене реакције јављају само у таквим условима. Азотна киселина и амонијак чине амонијум нитрат, такође важно ђубриво за усеве.
Примери киселина
Двадесет киселина је доле наведено као пример:
- Перхлорна киселина (ХЦлО4). То је јака киселинска течност а температура животна средина, високо оксидира.
- Азотна киселина (ХНО3). То је јака и интензивно оксидирајућа киселина, која се користи за производњу одређених експлозива, а такође и азотних ђубрива.
- Аскорбинска киселина (Ц.6Х.8ИЛИ6). То је витамин Ц, толико потребан за здравље. Заштитна је супстанца за своје антиоксидативне ефекте.
- Хлороводонична киселина (ХЦл(ац)). То је једина јака киселина коју људско тело синтетише, процес који се посебно јавља у желуцу да би извршио разградњу храна у процесу варења.
- Винска киселина (Ц.4Х.6ИЛИ6). То је бели кристални прах, користи се у припреми шумећих пића, у пекарској, винској и фармацеутској индустрији. Крема од зубног каменца коју носе неки рецепти је винска киселина.
- Флуороводонична киселина (ХФ(ац)). Због своје способности да напада стакло, користи се у клесању и гравирању.
- Сумпорна киселина (Х.2СВ4). То је јака киселина пар екцелленце, има безброј примена у разним индустрије и процеси синтезе.
- Трифлуоросирћетна киселина (Ц.2ВФ3ИЛИ2). То је добро отапало за многе органски састојци; састојци органског порекла.
- Фосфорна киселина (Х.3ПО4). Присутан је (у ниским концентрацијама) у разним пићима од коле. Сматра се штетним по здравље јер поспешује декалцификацију.
- Сирћетна киселина (ЦХ3ЦООХ). Главна је компонента сирћета. Киселост коју ствара чини га широко коришћеним конзервансом за храну.
- Флуороантимонска киселина (СбХФ6). То је најјача позната суперакиселина, која премашује киселост чисте сумпорне киселине за 1019.
- Хромна киселина (Х.2ЦрО4). То је тамно црвени прах, учествује у процесу хромирања. Такође се користи за застакљивање керамике.
- Индооцетна киселина (Ц.10Х.9НЕ2). Главни је представник ауксина, важних за хормоне раста биљке.
- Деоксирибонуклеинска киселина (ДНК). Она је та која је кључ живота, јер чини гене који управљају синтезом безбројних протеина.
- Трикарбоксилне киселине. Састоје се од групе карбоксилних киселина које имају три карбоксилне групе (-ЦООХ). Лимунска киселина (Ц.6Х.8ИЛИ7) То је један од њих.
- Мравља киселина (ЦХ2ИЛИ2). Најједноставнија је од органских киселина. Дуготрајно излагање овој киселини може проузроковати респираторну инсуфицијенцију и смрт.
- Глуконска киселина (Ц.6Х.12ИЛИ7). Соли ове киселине се широко користе у процесима чишћења стакленог посуђа.
- Млечна киселина (Ц.3Х.6ИЛИ3). Важан је део биохемијских процеса.
- Бензојева киселина (Ц.7Х.6ИЛИ2). То је киселина карактеристичног мириса која се широко користи за очување намирница којима је потребна пХ киселина.
- Јабучна киселина (Ц.4Х.6ИЛИ5). Широко се користи у фармацеутској индустрији за производњу лаксатива.
- Угљена киселина (Х.2ЦО3). Понегде је то део процеса формирања пећина. Присутан је у газираним пићима.
