Пример ковалентной связи
Химия / / July 04, 2021
В Ковалентная связь тот, в котором два атома объединяются, деля свои электроны, чтобы завершить свои правила октета.
История ковалентной связи
Это было в начале 20 века, когда химики начали понимать, как и почему образуются молекулы. Первый крупный прорыв произошел с предложением Гилберт Льюис о чем образование химической связи подразумевает, что атомы делят электроны. Льюис описал образование химической связи в водороде как:

Этот тип спаривания электронов является примером ковалентной связи, связи, в которой два электрона разделяют два атома. В Ковалентные соединения Они такие содержат только ковалентные связи.
Электроны в ковалентной связи
Для простоты общая электронная пара часто представляется как одна линия соединяя символы элементов. Таким образом, ковалентная связь молекулы водорода записывается как H-H.
В ковалентной связи каждый электрон общей пары притягивается к ядрам обоих атомов. Это притяжение удерживает два атома в молекуле H вместе.2 и он отвечает за образование ковалентных связей в других молекулах.
В ковалентных связях между атомами нескольких электронов участвуют только валентные электроны, которые являются крайними на самой мелкой орбите. От одного до трех из них будут участвовать в союзе.
Остальные электроны, не участвующие в связи, называются Несвязывающие электроны, или если мы организуем их попарно, Бесплатные пары. То есть пары валенсийских электронов, которые не участвуете в формировании ковалентных связей.
Представительство ковалентной связи
Структуры, которыми представлены ковалентные соединения, такие как H2 и F2 известны как Структуры Льюиса. Структура Льюиса - это представление ковалентной связи, где пара общих электронов обозначается линиями или парами точек между двумя атомами, а неподеленные свободные пары обозначены как пары точек на отдельных атомах. В структуре Льюиса показаны только валентные электроны, а не внутренние.
Учитывая структуру Льюиса молекулы воды H2Или все валентные электроны атомов водорода и кислорода отмечены первыми точками.
Во втором случае ссылка помечается линией. И бесплатные пары, которые будут существовать только в Oxygen, с очками.
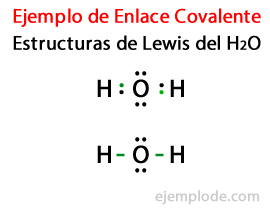
Правило октета
Образование этих молекул, как и у воды H2Или проиллюстрируйте звонок Правило октета, предложенный Льюисом: Атом, отличный от водорода, имеет тенденцию образовывать связи, пока не окружит себя восемь валентных электроновТо есть ковалентная связь образуется, когда для каждого отдельного атома недостаточно электронов для завершения своего октета.
Разделив электроны ковалентной связью, каждый атом завершает свой октет. Для водорода требуется получить электронную конфигурацию гелия, которая должна иметь в общей сложности два электрона.
Правило октета работает в основном для элементов второго периода или строки периодической таблицы. Эти элементы имеют подуровни, на которых может находиться всего восемь электронов.
Когда атом этих элементов образует ковалентное соединение, он приобретает электронную конфигурацию благородного неонового газа, разделяя электроны с другими атомами в том же соединении.
Типы ковалентных связей
Атомы могут образовывать разные типы ковалентных связей: Одиночные, парные или тройные.
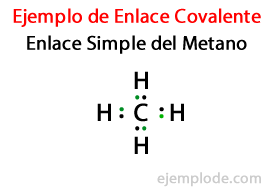
В Простая ссылка, два атома соединяются посредством Пара электронов. Они встречаются в подавляющем большинстве ковалентных соединений, и это самая основная форма этой связи.
Во многих соединениях Двойные ссылки, то есть когда два атома разделяют Две пары электронов. Если два атома разделяют две пары электронов, ковалентная связь называется двойной связью. Эти связи находятся в таких молекулах, как углекислый газ (CO2) и этилен (C2ЧАС4).

А Тройное звено возникает, когда два атома разделяют Три пары электронов, как в молекуле азота N2, молекула ацетилена C2ЧАС2.

Множественные связи короче одинарных ковалентных связей. В Длина ссылки определяется как расстояние между ядрами двух соединенных атомов ковалентной связью в молекуле.
Различия между ковалентными и ионными соединениями
Ионные и ковалентные соединения имеют заметные различия в своих общих физических свойствах из-за того, что их связи имеют разную природу.
в Ковалентные соединения существовать два типа сил притяжения; один из них является тот, который держит вместе атомы молекулы. Количественным показателем этого притяжения является энергия связи. Другая сила притяжения действует между целыми молекулами и называется Межмолекулярная сила. Поскольку межмолекулярные силы обычно слабее, чем силы, удерживающие атомы молекулы вместе, молекулы ковалентного соединения связываются с меньшей силой.
Следовательно, ковалентные соединения почти всегда являются легкоплавкими газами, жидкостями или твердыми телами.п. С другой стороны, электростатические силы, удерживающие ионы вместе в ионном соединении они обычно очень сильны, так что ионные соединения являются твердыми при комнатной температуре и имеют высокие температуры плавления. Многие ионные соединения растворимы в воде, а их водные растворы проводят электричество, поскольку эти соединения являются сильными электролитами.
Большинство из ковалентные соединения нерастворимы в воде, и если они растворятся, его водные растворы по-прежнему они не проводят электричество потому что эти соединения неэлектролиты. Расплавленные ионные соединения проводят электричество, потому что они содержат катионы и анионы, которые свободно перемещаются; жидкие или расплавленные ковалентные соединения не проводят электричество из-за отсутствия ионов.
Примеры ковалентно связанных соединений
- Ацетилен С2ЧАС2
- Метан CH4
- Этан C2ЧАС6
- Пропан C3ЧАС8
- Бутан С4ЧАС10
- Бензол C6ЧАС6
- Толуол C7ЧАС8
- Метиловый спирт CH3ой
- Этиловый спирт C2ЧАС5ой
- Пропиловый спирт C3ЧАС7ой
- Метиловый эфир CH3ОСН3
- Метилэтиловый эфир C2ЧАС5ОСН3
- Этиловый эфир C2ЧАС5OC2ЧАС5
- Муравьиная кислота HCOOH
- Уксусная кислота CH3COOH
- Пропионовая кислота C2ЧАС5COOH
- Масляная кислота C3ЧАС7COOH
- Двуокись углерода CO2
- Окись углерода CO
- Молекулярный азот N2
- Молекулярный водород H2



