Ce este electroliza
Chimie / / July 04, 2021
În chimie, Electroliză este fenomenul în care un curent electric trece printr-o soluție apoasă a unui compus ionic, și începe dirijează ionii (particule încărcate) ale compusului a doi electrozi, pozitiv (Anod, atrage anioni încărcați negativ) și negativi (Catod, atrage cationi încărcați pozitiv). Acest fenomen este guvernat de legea electrostaticii, care indică faptul că sarcinile opuse se atrag reciproc.
Electroliti
În 1883, Michael Faraday a descoperit că soluțiile apoase ale anumitor substanțe conduc curentul electric, în timp ce soluțiile altor substanțe nu.
Pentru a testa dacă o soluție apoasă conduce sau nu curentul electric, Faraday a proiectat un aparat simplu format dintr-un Circuit continuu de 110 volți, o lampă, Y doi electrozi metalici sau de grafit conectați la sursa curentă.
Dacă electrozii sunt scufundați în apă, cantitatea de curent care curge este atât de mică încât lampa nu se aprinde; același lucru este valabil dacă sunt scufundate într-o soluție de zahăr.
Dimpotrivă, dacă sunt scufundați într-o soluție de
Clorură de sodiu NaCl sau din Acid clorhidric HCl, lampa strălucește puternic, ceea ce dovedește că dizolvarea este un conductor excelent. Pe de altă parte, folosind acid acetic CH3COOH concentrat, soluția conduce curentul prost, dar când acidul este diluat cu apă H2Sau conductivitatea sa electrică crește.În timpul trecerii curentului prin diferite soluții, se obțin produse diferite la electrozi.
În cursul studiilor sale de electroliză, Faraday a dedus următoarele legi:
Prima lege: Cantitatea de substanță care are transformarea sa chimică într-un electrod este proporțională cu cantitatea de electricitate care trece prin soluție.
A doua lege: Dacă aceeași cantitate de energie electrică este trecută prin soluții diferite, greutatea substanțelor descompuse sau depuse pe diferiții electrozi sunt proporționale cu greutățile echivalente ale menționate substanțe.
Pentru a cita un exemplu:
Se va presupune că aveți cinci celule electrolitice diferite. Primul cu Acid clorhidric HCI, al doilea cu Sulfat de cupru CuSO4, al treilea cu Clorură antimonioasă SbCl3, al patrulea cu Clorură stânnoasă SnCl2 iar al cincilea cu Clorură stanică SnCl4.
Același curent este trecut printr-o serie de celule electrolitice, până când au fost eliberate 1.008 grame de hidrogen (o Greutatea echivalentă a hidrogenului) a soluției de acid clorhidric, greutățile (în grame) ale celorlalte produse eliberate în același timp Sunt:

Greutate echivalentă are valoarea de Greutatea atomică a elementului împărțită la Valencia elementului.
Pentru a elibera o Greutate echivalentă cu orice articol, aveți nevoie 96500 Coulombs. Această cantitate de electricitate se numește 1 Faraday.
Unitatea Faraday
Ampere este definit ca un flux uniform care depune 0,001118 grame de argint (Ag) dintr-o soluție de azotat de argint (AgNO3) intr-o secunda. Deoarece greutatea atomică a argintului este de 107,88 g / mol, raportul 107,88 / 0,001118 dă numărul de Ampere-secunde sau Coulombs electricitate necesară să depună un echivalent chimic de argint. Această cantitate este 96494 Coulombs (valoarea 96500 este destul de aproximativă pentru calcule mai simple) și se numește 1 Faraday de electricitate.
Electrozi
A sunat Faraday Anod la electrod pozitiv și catod la electrod negativ. De asemenea, el a creat termenii Anion și Cation, aplicați substanțelor care apar respectiv la anod și la catod în timpul Electrolizei.
În prezent, o altă definiție pentru electrozi este:
Anod: Electrod în care există pierderi de electroni sau oxidare.
Catod: Electrod în care există câștig sau reducere de electroni.
Electroliti și non-electroliți
Conducerea curentului electric prin soluții nu a fost explicată în mod satisfăcător până în 1887, când Svante Arrhenius și-a făcut cunoscută teoria. Înainte de a aprecia și înțelege teoria lui Arrhenius, am expus mai întâi câteva dintre faptele cunoscute științei atunci când Arrhenius a formulat-o:
Soluții non-electrolitice au proprietăți care pot fi calculate prin aplicarea legii lui Raoult. Presiunile de vapori și punctele de fierbere și îngheț observate ale acestor soluții sunt practic aceleași cu valorile calculate.
Legea lui Raoult explică faptul că presiunea de vapori a fiecărui soluție în soluție depinde de propria sa fracțiune molară din ea, înmulțită cu presiunea sa de vapori în stare pură.

Legea lui Raoult eșuează atunci când este aplicată soluțiilor de electroliți în apă. Variațiile presiunii vaporilor și ale punctelor de fierbere și îngheț sunt întotdeauna mai mari decât cele prevăzute de legea menționată anterior și, în plus, cresc atunci când se diluează.
Astfel de abateri sunt reprezentate de valoarea i, care este raportul dintre variația observată în punctul de îngheț între variația calculată în punctul de îngheț:

Valoarea lui i este o măsură a abaterii de la Legea lui Raoult, fiind egală cu 1 atunci când nu există nicio abatere.
Conductivitatea electrică a electroliților
Arrhenius a investigat conductivitatea soluțiilor apoase de electroliți pentru a afla cum variază conductivitatea cu concentrația de electroliți.
A măsurat conductivitatea molară (care este conductivitatea corespunzătoare unui mol de electrolit dizolvat; adică conductivitatea specifică se referea la un mol și a constatat că a crescut odată cu diluarea.
Arrhenius și-a comparat rezultatele cu măsurători ale abaterilor de la legea lui Raoult și a găsit o relație strânsă între acestea și conductivitatea molară. În teoria sa se explică comportamentul electroliților:
„Moleculele electrolitice se disociază în particule încărcate electric numite ioni. Dizolvarea este incompletă și există un echilibru între molecule și ionii lor. Ionii conduc curentul pe măsură ce se deplasează în interiorul soluției ”.
Abaterile de la legea lui Raoult se datorează creșterii numărului de particule rezultate din disocierea parțială a moleculelor.
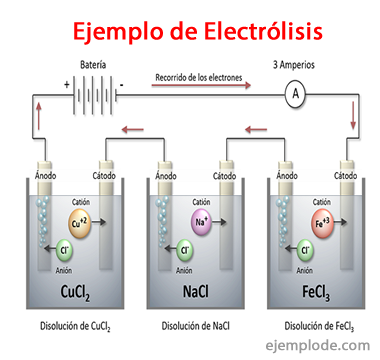
Exemple de electroliză
Unele soluții care se comportă ca electroliții, adică au capacitatea de electroliză sunt:
Clorură de sodiu NaCl
Acid clorhidric HCI
Sulfat de sodiu Na2SW4
Acid sulfuric H2SW4
Hidroxid de sodiu NaOH
Hidroxid de amoniu NH4Oh
Carbonat de sodiu Na2CO3
Bicarbonat de sodiu NaHCO3
Acid azotic HNO3
Nitrat de argint AgNO3
Sulfat de zinc ZnSO4
