Tipos de ligações químicas
Química / / July 04, 2021
Quando dois ou mais átomos formam uma molécula, eles se unem por meio de um junção entre elétrons de suas últimas camadas, as mais superficiais. Esta união é chamada Ligação química. Para que uma ligação química se forme, os átomos devem ter seus octeto incompleto, ou seja, menos de oito elétrons em sua última camada, que é o número que lhes dará estabilidade química.
Existem três tipos de ligações químicas:
- Ligações ionicas
- Ligações covalentes
- Elos de metal
Ligações ionicas
Ligações iônicas são aquelas em que os elétrons de valência são atraídos por forças eletrostáticas. O (s) átomo (s) que têm de 1 a 4 elétrons de valência podem entregá-los para formar a ligação; Isso lhe dá uma carga positiva, porque estaria se livrando das cargas negativas. Por outro lado, o (s) átomo (s) com 5 a 7 elétrons de valência poderão receber os necessários para atingir 8.
Isso lhes dá uma carga negativa, porque eles captam elétrons, que são negativos. O fato de que os elétrons podem ser capturados ou entregues dá aos átomos a carga elétrica
. De acordo com a lei de Coulomb, as cargas formadas em ambos os átomos eles vão se atrair com uma força, que é a eletrostática mencionada acima. Cargas negativas atraem cargas positivas e vice-versa. Cargas opostas atraem. Uma vez que essa força os une, a molécula é formada.Ligações iônicas ocorrem principalmente entre átomos metálicos e não metálicos. Os metais abrem mão de seus elétrons e sempre carregam uma carga positiva, participando como um cátion (+). Não metais são receptores de elétrons e geralmente carregam uma carga negativa, participam como ânions (-) mas também acontece que eles carregam uma carga positiva, isso quando eles formam grupos de átomos carregados chamado radicais, como amônio NH4+, carbonato de CO3-2, fosfato PO4-3.
Entre os compostos químicos formados por ligações iônicas estão:
- Sais binários
- Oxisales
Quando essas substâncias são dissolvidas na água eles se dissociam, quer dizer, separar em suas cargas elétricas e estes são dispersos na água junto com os íons de hidrogênio H+ e hidroxil (OH-) que formam água. A mistura que se forma é uma solução chamada eletrólito.
- Continue lendo: Ligação iônica

Ligações covalentes
Ligações covalentes são aquelas em que os elétrons são compartilhados sem separá-los do átomo, ou seja, sem a formação de cargas elétricas. Os átomos são mantidos juntos pela proximidade e usam a força com a qual o núcleo atrai elétrons. Uma vez formada a ligação, os dois ou mais núcleos dos átomos acabam atraindo os elétrons compartilhados, cumprindo assim a regra do octeto e tornando a molécula estável.
Existem várias formas de ligação covalente, e são elas:
- Ligação covalente
- Ligação covalente coordenada
- Ligação covalente polar
- Ligação covalente não polar
O ligação covalente É exatamente como o descrito no início. Os átomos participantes compartilham elétrons para que todos tenham seu octeto completo. Não há cargas elétricas aqui, porque nenhum elétron é derramado, eles são apenas compartilhados.
No ligação covalente coordenada é apenas um átomo que contribui com todos os elétrons necessários para a ligação. O outro átomo simplesmente se liga e leva esses elétrons como seus. A molécula é formada assim. É o caso, por exemplo, do ácido sulfúrico H2SW4 em que o enxofre compartilha dois pares de elétrons com átomos de oxigênio.
No ligação covalente polar, as forças entre os átomos são inclinadas para um lado da molécula. Esta quando existem diferentes tipos de átomos na molécula. Essa força é medida em unidades de Debye, e quanto mais alto seu valor em um lado da molécula, mais polar será. Isso significa que os pólos são formados na estrutura e é por isso que recebem esse nome. Suas forças são assimétricas.
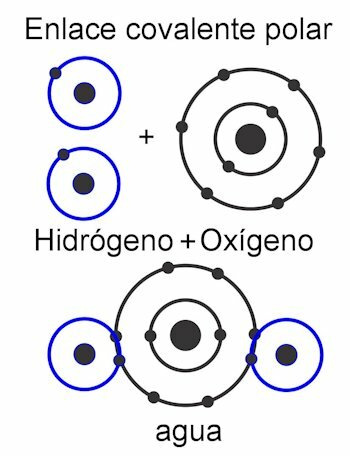
No ligação covalente não polar, as forças entre os átomos são uniformes em toda a molécula e, portanto, nenhum pólo é formado em sua estrutura. Funciona como uma unidade única e por isso é muito difícil, quase impossível, dividir suas cargas. Isso o torna insolúvel em água. Este é o caso de compostos como alcanos, que têm suas forças iguais em toda a molécula. Suas forças são simétricas.

- Continue lendo: Ligação covalente
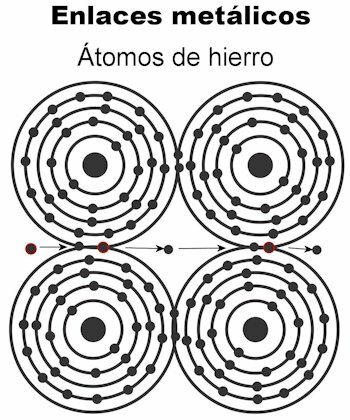
Ligação metálica
Os átomos de um metal são mantidos juntos por meio de ligações metálicas. Nesse tipo de ligação, os elétrons de todos os átomos são atraídos para formar uma rede cristalina que permanece firme. As ligações da estrutura cristalina têm todos os elétrons intercalados e arranjado para transportar corrente elétrica e calor quando é transmitido a eles. Nos metais de transição, essa estrutura de ligações metálicas é mais notável, pois seus átomos são maiores.
Exemplos de ligação iônica
Algumas substâncias que possuem ligações iônicas são:
- Cloreto de sódio NaCl. Seus íons são Na+ e Cl-.
- Cloreto de potássio KCl. Seus íons são K+ e Cl-.
- Cloreto de cálcio CaCl2. Seus íons são Ca+2 e Cl-.
- Cloreto de magnésio MgCl2. Seus íons são Mg+2 e Cl-.
- Cloreto de Estrôncio SrCl2. Seus íons são Sr+2 e Cl-.
- Cloreto de Bário BaCl2. Seus íons são Ba+2 e Cl-.
- Cloreto de Alumínio AlCl3. Seus íons são Al+3 e Cl-.
- Sulfato de sódio Na2SW4. Seus íons são Na+ Eu sou4-2.
- Sulfato de potássio K2SW4. Seus íons são K+ Eu sou4-2.
- Sulfato de cálcio CaSO4. Seus íons são Ca+2 Eu sou4-2.
- Sulfato de cálcio MgSO4. Seus íons são Mg+2 Eu sou4-2.
- Sulfato de Estrôncio SrSO4. Seus íons são Sr+2 Eu sou4-2.
- Sulfato de Bário BaSO4. Seus íons são Ba+2 Eu sou4-2.
- Na fosfato de sódio3PO4. Seus íons são Na+ e PO4-3.
- Fosfato de potássio K3PO4. Seus íons são K+ e PO4-3.
- Fosfato de magnésio Mg3(PO4)2. Seus íons são Mg+2 e PO4-3.
- Fosfato de cálcio Ca3(PO4)2. Seus íons são Ca+2 e PO4-3.
- Fosfato de Alumínio AlPO4. Seus íons são Al+3 e PO4-3.
- Fosfato Ferroso Fe3(PO4)2. Seus íons são Fe+2 e PO4-3.
- Fosfato Férrico FePO4. Seus íons são Fe+3 e PO4-3.
Exemplos de ligação covalente
Algumas substâncias que apresentam ligações covalentes são:
- Metano CH4.
- Etano C2H6.
- Propano C3H8.
- Butano C4H10.
- Pentano C5H12.
- Hexano C6H14.
- Heptano C7H16.
- Octane C8H18.
- Propileno CH2= CH2-CH3.
- Acetileno C2H2.
- Álcool metílico CH3
- Álcool etílico C2H5
- Álcool propílico C3H7
- Álcool isopropílico CH3CH (OH) CH3.
- 2-propanona ou acetona CH3Carro3.
- Formaldeído HCHO.
- Acetaldeído CH3
- Propionaldeído CH3CH2
- Butiraldeído CH3CH2CH2
- Ácido fórmico HCOOH.
Exemplos de ligação metálica
Algumas substâncias que apresentam ligação metálica são:
- Zinco Zn
- Cádmio Cd
- Cobre cobre
- Silver Ag
- Ouro ouro
- Ni níquel
- Palladium Pd
- Platinum Pt
- Cobalt Co
- Ródio Rh
- Iridium Go
- Ferro Fe
- Rutênio Ru
- Osmium Os
- Manganês Mn
- Cromo Cr
- Molibdênio Mo
- Wolfram W
- Vanadium V
- Zrconium Zr
Siga com:
- Átomos
- Íon
- Metais
- Sem metais
- Alcanos
- Soluções


