Organiskās ķīmijas piemērs
Ķīmija / / July 04, 2021
The Organiskā ķīmija Tā ir vispārējās ķīmijas daļa, kas atbild par pētījumu un ķīmisko savienojumu funkcionālo klasifikāciju, kuras strukturālais elements ir Ogleklis, kas pārpilnībā atrodas dzīvā matērija; tādējādi tiek izveidots labi diferencēts neorganiskās ķīmijas Visums, kas veltīts ķīmiskajiem savienojumiem, kas klasificēti kā minerāli.
Oglekļa atomā tā elektroniskās konfigurācijas pēdējā apvalkā ir četri elektroni. Šī īpašība kopā ar tās atomu rādiusu ļauj to savienot ar citām kovalentām saitēm tā paša elementa atomi daudzās ķēdēs, veidojot lielu ķīmisko savienojumu daudzveidību stabils.
Jūs varat pārbaudīt Kovalentās saites.
Šādi ķīmiskie savienojumi papildus oglekļa atomiem, kas piešķir tiem sākotnējo struktūru, satur ūdeņraža atomus kā galveno oglekļa valences papildinājumu. Turklāt šajā savienojumu daudzveidībā ir arī tie, kas iejaucas skābekļa atomos, Slāpeklis, halogēni, sērs un pat fosfors, sārmainā un sārmainā zemes elementi un pāreja. Atkarībā no tā, kurš ir iesaistīts molekulā, tās būs galīgās vielas fizikālās un ķīmiskās īpašības.
The organiskie savienojumi ir visā ES dzīvā matērija; veicināt un atbalstīt visus bioloģiskās funkcijas, atšķirībā no neorganiskām vai minerālvielām, kuras cilvēki izmantojuši komerciāliem mērķiem, eksperimentiem vai noteiktu mājas uzdevumu veikšanai.
Organiskās ķīmijas vēsture
Pirms 1828. gada jau tika nošķirta organiskā ķīmija no neorganiskās ķīmijas. Organiskā viela bija saistīta ar radīšanu, izmantojot a "vitālais spēks"un neorganiskajam ar nedzīvo, ar minerālu. Ņemot vērā šīs koncepcijas, nevarēja cerēt, ka laboratorijā organiskos savienojumus iegūst no neorganiskiem materiāliem.
Tomēr 1828. gadā Frīdrihs Vēlers (1800-1882) izdevās sagatavot organisko vielu - Karbamīda CO (NH2)2, kas ir svarīgs dzīvnieku vielmaiņas produkts, no neorganiskiem savienojumiem. Ārstēšana Svina cianāts Pb (CNO)2 ar Amonjaks NH3 dabūt Amonija cianāts NH4CNO; Šis savienojums patiešām tika izveidots, bet, kad šķīdums tika vārīts, lai kristalizētu amonija cianātu, tas tika pārveidots par karbamīdu.
Šīs ķīmiskās izmaiņas ir piemērs Iekšējā pārgrupēšana, kurā molekulu atomu skaits vai klase nemainās, bet tikai to secība tajā. Šāda veida transformācijas organiskajā ķīmijā ir ļoti izplatītas.
Vēlāk Wöhlera atklājums izraisīja atteikšanos no dzīvības spēka teorijas pilnībā izmesti, sekojot daudzu citu organisko savienojumu sagatavošanai laboratorija. Neskatoties uz to, pastāv neorganisko un organisko īpašību raksturotāji, jo neorganiskie savienojumi ir saistīti ar minerālu produktiem un organiskie savienojumi, kas faktiski ir oglekļa un ūdeņraža savienojumi, un to atvasinājumi, ir tāda veida dzīvie organismi.
Lai gan vispārējās ķīmijas likumi vienādi attiecas uz abiem savienojumiem, dažādi cēloņi pamato un padara šo sadalījumu nepieciešamu. Tādējādi organiskie un neorganiskie savienojumi atšķiras ar dažādām īpašībām, piemēram: to Šķīdība vēlams organiskos šķīdinātājos (ēterī, spirtā, hloroformā utt.) un attiecīgi ūdenī Stabilitāte (organiskie savienojumi sadalās samērā zemā temperatūrā), un Reakciju raksturs; neorganiskiem savienojumiem tie ir joniski, vienkārši un praktiski momentāni, un organiskiem savienojumiem tie ir kovalenti, sarežģīti un lēni.
Organiskie savienojumi
Ir zināmi oglekļa savienojumi ar ķēdēm līdz deviņdesmit atomiem. The ķēdes Oglekļa atomi var būt lineāra un sazarota un tām ir atsevišķas kovalentās saites vai ir dubultās vai trīskāršās saites. Ir zināms, ka vairāk nekā 2500 savienojumu satur tikai oglekli un ūdeņradi (Ogļūdeņraži).
Organisko savienojumu izomērija
Neorganiskos savienojumos formula parasti apzīmē vienu savienojumu; tādējādi ir tikai viena viela ar formulu H2DR4. Sērskābes molekula satur divus ūdeņraža atomus, vienu no sēra un četrus skābekļa, īpašā un unikālā izkārtojumā. Organiskajos savienojumos tas ir reti tas notiek. Tā, piemēram, ir divi savienojumi, kas reaģē uz formulu C2H6Vai arī etilspirts vai etanols un dimetilēteris.
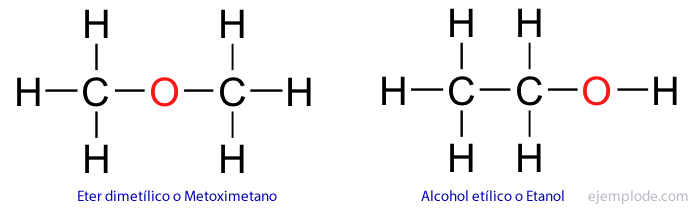
Jo sarežģītāka ir molekula, tas ir, jo lielāks ir oglekļa atomu skaits, jo lielāks ir iespējamo izomēru skaits.
Organisko savienojumu analīze
Organiskā savienojuma analīze ietver kvalitatīvā analīze, kvantitatīvā analīze un Funkcionālā analīze. Pieņemot, ka savienojums ir nešķīstā stāvoklī, to iepriekš attīra Kristalizācija, Destilācija, Sublimācija, Ekstrakcijautt. Tīrības kritēriju var vērtēt, pamatojoties uz tā fizikālajām konstantēm, piemēram, kušanas temperatūra, viršanas temperatūra, blīvums, šķīdība, kristāliskā forma, refrakcijas indekss utt.
The kvalitatīvā analīze To pārbauda, izpētot savienojumu veidojošo elementu klātbūtni, īpaši oglekļa, ūdeņraža un slāpekļa un dažreiz halogēnu, sēra un fosfora klātbūtni.
The kvantitatīvā analīze Tas tiek veikts, par pamatu izmantojot kvalitatīvās analīzes metodes. Sākumpunkts ir noteikts vielas daudzums, kas tiek sadedzināts, un oglekļa dioksīds tiek savākts un nosvērts. oglekļa un ūdens tvaiki, kas izveidoti, lai aprēķinātu oglekļa un ūdeņraža procentuālo daudzumu ūdenī savienojums. Kvantitatīvās analīzes rezultāti atvieglo empīriskā formula, lai gan molekulāro formulu var atrast tikai pēc vielas molekulmasas noteikšanas. Bet problēma vēl nav atrisināta, jo viena un tā pati molekulārā formula var atbilst dažādiem izomēriem.
Organisko savienojumu klasifikācija
Organiskie savienojumi pēc to struktūras tiek sadalīti savienojumos alifātisks, aromātisks Jā heterociklisks. Alifātiskie savienojumi ir saistīti ar metānu CH4, ir atvērtas ķēdes, izņemot cikloparafīnus, un to nosaukums ir jāpateicas tam, ka dzīvnieku un augu tauki pieder šai grupai.
The aromātiskie savienojumi, slēgta ķēde, cieši saistīta ar benzolu, C6H6, un viņi ir parādā savu vārdu tam, ka daudziem no viņiem ir smaržīgas, patīkamas smaržas.

Benzola gredzens
The heterocikliskie savienojumi Tie ir slēgtas ķēdes savienojumi, kuros gredzenā ir cits elements nekā ogleklis.
Pēc savas konstitūcijas viņi ir:
Ogļūdeņraži, kas savukārt savu saišu veida dēļ tiek klasificēts kā Alkāni, Alkēnus Jā Alkīni. Turklāt šajā kategorijā ietilpst cikloalkāni, benzols un to atvasinājumi, kas sastāv tikai no oglekļa un ūdeņraža.
Heterocikliskie savienojumi
Halogenētie atvasinājumi:R-X
Nitro savienojumi:R-NĒ2
Sulfonskābes:R-SO3H
Nitrili (OR alkilcianīdi) un izonitrili:R-CN un R-NC. Tās atšķiras ar to, kā slāpekļa atoms ir saistīts molekulā.
Spirti:R-OH
Fenoli: Savienojumi, kuru pamatā ir mugurkauls, kas sastāv no benzola gredzena ar pievienotu hidroksilgrupu.

Ēteri:R-O-R
Merkaptāni: R-SH
Tioēteri:R-S-R
Tioīnskābes:R-COSH
Aldehīdi:R-CHO
Ketoni:R-CO-R
Karboksilskābes:R-COOH
Tu ej ārā:R-COOM (M metālam)
Esteri: R-COO-R
Anhidrīdi: R-CO-O-OC-R
Amini:R-NH2, R-NH-R, 2R-N-R
Aldosa tipa ogļhidrāti:-CHOH-CHOH-CHO
Ketozes tipa ogļhidrāti:-CHOH-CO-CH2Ak
Metālorganiskie savienojumi:R-M-R
Metāla alkilhalogenīdi:R-MX (pazīstams arī kā Grignard reaģenti)


