Raula likuma definīcija
Miscellanea / / February 21, 2022
jēdziena definīcija
Tas ir viens no ķīmijas likumiem, ko izstrādājis francūzis Rau, kurā ir noteikts, ka parciālais tvaika spiediens komponents, kas veido maisījumu, ir vienāds ar tā paša tīrā komponenta parciālā spiediena reizinājumu ar tā molu daļu maisījumā. sajauc.

Ķīmijas inženieris
Iespējams, ir nepieciešams no jauna definēt tvaika spiediena jēdzienu, saprotot to kā spiedienu, ko gāzveida fāze iedarbojas uz šķidro fāzi (gan Līdzsvars), noteiktā laikā temperatūra slēgtā sistēmā. Šis dinamiskais līdzsvars tiek sasniegts ātrāk, jo lielāka ir saskares virsma starp fāzēm, un šajā stāvoklī mēs runājam par piesātinātām fāzēm, gan tvaiku, gan piesātinātu šķidrumu.
Šis likumu ielika vienu no pamatiem termodinamika 1887. gadā un pēc tam loģika No Raula likuma redzams, ka vielas tvaika spiediena vērtība samazinās, kad tā no tīras kļūst par maisījuma daļu. Pamatojoties uz iepriekš minēto, izteiksme Tā matemātika ir šāda:
Pi = xiL Pi0
Tas nozīmē, ka vielas i daļējais tvaika spiediens maisījumā P_i ir vienāds ar tīrās sastāvdaļas tvaika spiedienu P
i0, (tajā pašā temperatūrā) reizināta tā mola daļa šķidrajā fāzē, xiL.Runājot par šo likumu, mēs atsaucamies uz tipiskiem grafikiem, piemēram:
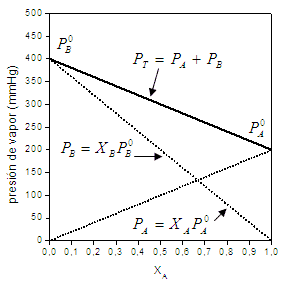
Attēls ņemts no UCR3
šis vienkārši grafisks Tas ir ļoti noderīgi, lai novērtētu daļēju tvaika spiedienu, ja viela ir maisījuma sastāvdaļa, tas arī ļauj aprakstīt maisījuma gaistošo šķīdinātāju sastāvu tā gāzveida fāzē, kā arī daudzus citus Lietojumprogrammas.
Raula likuma matemātiskā izteiksme tika norādīta katrā grafikā maisījuma A un B komponentiem, šajā gadījumā bināram maisījumam, ko veido divas tīras vielas. Uz abscisu ass mēs novērojam molārās frakcijas, kas atbilst katram komponentam (šķidrā fāzē), kas atrodas pa kreisi lielāks komponenta B daudzums un proporcionāli mazāks komponenta A daudzums, līdz komponenta B molārā daļa ir 1 un A molārā daļa ir 0. Savukārt pa labi komponenta A daļa palielinās, līdz tiek iegūta tikai sastāvdaļa A (xA=1). Attiecīgi uz ordinātu ass mums ir tīro komponentu tvaika spiediens, tas ir, ja tikai ir komponents A (xA=1), mums ir šīs pašas sastāvdaļas tvaika spiediens un, otrādi, tas notiek uz ordinātu ass pa kreisi. Pārejā kopējais gāzes fāzes maisījuma spiediens neatbilst katras sastāvdaļas tvaika spiedienam. bet gan tā komponentu daļējā spiediena summai (Daltona likums), katrs no tiem tiek novērtēts no likuma Rauls.
Jāatzīmē, ka sākotnējā likumā ir modifikācijas, kuru pamatā ir novirzes no tā savienojumu idealitātes. Kad, atkarībā no starpmolekulāriem spēkiem, kas stājas spēlē, starp abiem notiek mijiedarbība Tas rada novirzes, jo vienai no tām būs lielāka vai mazāka tendence palikt fāzē šķidrums vai nē.
Īsāk sakot, ja novirze ir negatīva no Raula ideālā likuma, starpmolekulārie spēki šķīdumā ir lielāki nekā tīrajos komponentos, tāpēc kopējais spiediens būs mazāks par Aptuvenais. Tas nozīmē, ka adhezīvie spēki ir stiprāki par kohēzijas spēkiem, kas nozīmē, ka sastāvdaļas tiek aizturētas maisījuma šķidrajā fāzē ar spēku pievilcība lielāks nekā tīriem šķidrumiem. No otras puses, ja novirze ir pozitīva, kopējais spiediens būs lielāks par aprēķināto, jo starpmolekulārie spēki šķīdumā ir mazāki nekā tīrajos komponentos. Šeit kohēzijas spēki starp molekulām ir svarīgāki par adhezīviem spēkiem, tāpēc komponentiem vieglāk pāriet gāzes fāzē.
Galvenokārt Raula likums tiek izmantots rūpnieciskajās tehnikās un mērogs laboratorijā, tādos procesos kā destilācija un frakcionēta destilācija.
Tēmas Raula likumā