Primjer kovalentne veze
Kemija / / July 04, 2021
The Kovalentna veza je onaj u kojem dva atoma ujedinjuju se dijeleći svoje elektrone, kako biste upotpunili svoja pravila okteta.
Povijest kovalentne veze
Početkom 20. stoljeća kemičari su počeli shvaćati kako i zašto nastaju molekule. Prvo veliko otkriće došlo je s prijedlogom Gilbert lewis o čemu stvaranje kemijske veze podrazumijeva da atomi dijele elektrone. Lewis je opisivao stvaranje kemijske veze u vodiku kao:

Ova vrsta elektronskog uparivanja primjer je kovalentne veze, veze u kojoj dva elektrona dijele dva atoma. The Kovalentni spojevi Oni su to sadrže samo kovalentne veze.
Elektroni u kovalentnoj vezi
Radi jednostavnosti, zajednički elektronski par često je predstavljen kao jedna linija povezujući simbole elemenata. Dakle, kovalentna veza molekule vodika napisana je kao H-H.
U kovalentnoj vezi svaki elektron zajedničkog para privlače jezgre oba atoma. Ova privlačnost drži dva atoma u molekuli H zajedno.2 a odgovoran je za stvaranje kovalentnih veza u drugim molekulama.
U kovalentnim vezama između atoma nekoliko elektrona
sudjeluju samo valentni elektroni, koji su najudaljeniji, u najplićoj orbiti. Između jednog i troje njih sudjelovat će u uniji.Pozvani su ostali elektroni koji ne sudjeluju u vezi Nelepivi elektroni, ili ako ih organiziramo u parove, Besplatni parovi. Odnosno, parovi Valencia Electrons koji ne sudjeluju u stvaranju kovalentnih veza.
Zastupljenost kovalentnih veza
Strukture s kojima su zastupljeni kovalentni spojevi, poput H2 i F2 poznati su kao Lewisove strukture. Lewisova struktura je a predstavljanje kovalentne veze, gdje je par zajedničkih elektrona označene crtama ili kao parovi točaka između dva atoma, a nepodijeljeni slobodni parovi označeni su kao parovi točaka na pojedinačnim atomima. U Lewisovoj strukturi prikazani su samo valentni elektroni, a ne i unutarnji.
Uzimajući u obzir Lewisovu strukturu za molekulu vode H2Ili su svi valentni elektroni atoma vodika i kisika prvo označeni točkama.
U drugom slučaju, veza je označena crtom. I besplatni parovi, koji će postojati samo u kisiku, s bodovima.
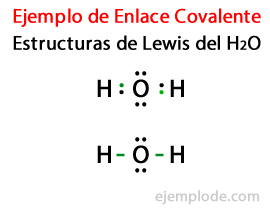
Pravilo okteta
Stvaranje ovih molekula, poput onih iz vode H2Ili, ilustrirajte poziv Pravilo okteta, koji je predložio Lewis: Atom koji nije Vodik nastoji stvarati veze sve dok se ne okruži osam valentnih elektronaOdnosno, kovalentna veza nastaje kad za svaki pojedini atom nema dovoljno elektrona da završi svoj oktet.
Dijeleći elektrone u kovalentnoj vezi, svaki atom završava svoj oktet. Za vodik je uvjet da dobijete elektroničku konfiguraciju helija, koja će imati ukupno dva elektrona.
Pravilo okteta uglavnom djeluje za elemente drugog razdoblja ili retka periodnog sustava. Ti elementi imaju podrazine u kojima može biti ukupno osam elektrona.
Kada atom ovih elemenata tvori kovalentni spoj, on dobiva elektroničku konfiguraciju neonskog plemenitog plina, dijeleći elektrone s ostalim atomima u istom spoju.
Vrste kovalentnih veza
Atomi mogu tvoriti različite vrste kovalentnih veza: Samci, parovi ili trojke.
U Jednostavna poveznica, dva atoma spojena su pomoću Par elektrona. Javljaju se u velikoj većini kovalentnih spojeva i to je najosnovniji oblik ove veze.
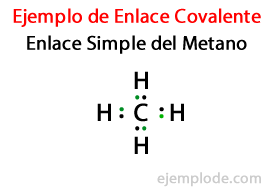
U mnogim spojevima, Dvostruke veze, odnosno kada dva atoma dijele Dva para elektrona. Ako dva atoma dijele Dva para elektrona, kovalentna veza naziva se dvostruka veza. Te se veze nalaze u molekulama poput ugljičnog dioksida (CO2) i etilen (C2H4).

A Trostruka veza nastaje kad dva atoma dijele Tri para elektrona, kao u molekuli Dušika N2, molekula acetilena C2H2.

Višestruke veze kraće su od jednokovalentnih. The Duljina veze definira se kao udaljenost između jezgre dva spojena atoma kovalentnom vezom u molekuli.
Razlike između kovalentnih i jonskih spojeva
Jonski i kovalentni spojevi predstavljaju značajne razlike u svojim općim fizikalnim svojstvima, zbog činjenice da su njihove veze različite prirode.
U Kovalentni spojevi postoje dvije vrste privlačnih sila; jedan od njih je onaj koji drži zajedno atome molekule. Kvantitativna mjera ove privlačnosti je energija vezanja. Druga sila privlačenja djeluje između kompletnih molekula i naziva se Intermolekularna sila. Budući da su intermolekularne sile obično slabije od sila koje atome molekule drže zajedno, molekule kovalentne spojne veze imaju manju silu.
Uzastopno, kovalentni spojevi su gotovo uvijek plinovi, tekućine ili krute tvari s niskim talištemn. S druge strane, elektrostatičke sile koje drže ione zajedno u ionskom spoju su obično vrlo jaki, tako da su ionski spojevi čvrsti na sobnoj temperaturi i imaju visoka tališta. Mnogi su ionski spojevi topljivi u vodi, a njihove vodene otopine provode električnu energiju jer su ti spojevi snažni elektroliti.
Većina kovalentni spojevi su netopivi u vodi, i ako se otope, njegove vodene otopine kao i obično ne provode struju jer su ti spojevi neelektroliti. Topljeni ionski spojevi provode električnu energiju jer sadrže kation i anione koji se slobodno kreću; tekući ili rastopljeni kovalentni spojevi ne provode električnu energiju jer nisu prisutni ioni.
Primjeri kovalentno vezanih spojeva
- Acetilen C2H2
- Metan CH4
- Etan C2H6
- Propan C3H8
- Butan C4H10
- Benzen C6H6
- Toluen C7H8
- Metilni alkohol CH3Oh
- Etilni alkohol C2H5Oh
- Propilni alkohol C3H7Oh
- Metil eter CH3OCH3
- Metil etil eter C2H5OCH3
- Etilni eter C2H5OC2H5
- Mravlja kiselina HCOOH
- Octena kiselina CH3COOH
- Propionska kiselina C2H5COOH
- Maslačna kiselina C3H7COOH
- Ugljični dioksid CO2
- Ugljični monoksid CO
- Molekularni dušik N2
- Molekularni vodik H2


