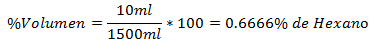Esimerkki konsentraatiosta: Molaarisuus, molaarisuus, normaalisuus ja prosenttiosuus
Kemia / / July 04, 2021
Keskittyminen on määritelty Tietyn liuoksessa olevan aineen määrä tai osuus. Ratkaisu on a homogeeninen seos (näkyvissä yksi vaihe) kiinteä, nestemäinen tai kaasumainen, joten pitoisuus voidaan ilmaista eri tavoin.
On tarpeen määritellä, että ratkaisu sisältää kaksi pääkomponenttia: Liuotin ja liuotin, ja yleensä keskittyminen keskittyy ilmaisemaan kuinka paljon liuenneita aineita sekoitetaan koko liuokseen. Kuitenkin Pitoisuus voi ilmaista niiden määrän tai osuuden.
Pitoisuuden ilmaisu
Kemian alalla liuoksessa olevan aineen määrä voidaan ilmaista useilla eri tavoilla: Molaarisuus, molaarisuus, normaalisuus, prosenttiosuus painosta, tilavuusprosentti.
Näistä viidestä yksiköstä kaikki voidaan levittää kiinteisiin, nestemäisiin ja kaasumaisiin liuoksiin. Mutta esimerkiksi molaarisuutta käytetään eniten kiinteisiin ratkaisuihin.
Esimerkkejä molaarisuudesta
Molaarisuus osoittaa, kuinka monta moolia ainetta on jokaisessa litraa täydellistä liuosta. Se on nestemäisten liuosten kemiassa eniten käytetty yksikkö, kun tehdään tilavuusanalyysiä. Se on merkitty kirjaimella "M".
Tietäen liuenneen aineen grammat, ne jaetaan liuenneen aineen molekyylipainolla. Täten saadaan liuoksessa läsnä olevat liuenneen aineen moolit.
Sitten liuenneen aineen moolit jaetaan liuoksen litroilla, ja siten saadaan molaarisuusyksiköt: liuoksen moolia / litra liuosta.
1. - Liuokselle, jossa on 0,5 litraa magnesiumhydroksidia [Mg (OH)2] ja jos magnesiumhydroksidin molekyylipaino on 58 g / mol. Sinulla on 36 grammaa sitä.

2. - 1 litran kalsiumhydroksidiliuokselle [Ca (OH)2] ja jos kalsiumhydroksidin molekyylipaino on 74 g / mol. Sinulla on 42 grammaa sitä.

3.- Liuokselle, jossa on 3 litraa natriumkloridia (NaCl) ja jos natriumkloridin molekyylipaino on 58 g / mol. Sinulla on 28 grammaa sitä.
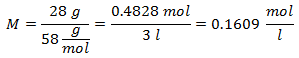
4.- Liuokselle, jossa on 5 litraa kalsiumkloridia (CaCl2), ja jos kalsiumkloridin molekyylipaino on 110 g / mol. Sinulla on 13 grammaa sitä.

5.- Liuokselle, jossa on 10 litraa natriumsulfaattia (Na2SW4), ja jos natriumsulfaatin molekyylipaino on 142 g / mol. Sinulla on 96 grammaa sitä.

Esimerkkejä molaalisuudesta
Molaalisuus osoittaa, kuinka monta moolia liuotinta on 1000 grammaa liuotinta kohti ratkaisussa. Se on kemiassa yleisimmin käytetty kiinteiden liuosten yksikkö. Se on merkitty kirjaimella "m".
Tietäen liuenneen aineen grammat, ne jaetaan liuenneen aineen molekyylipainolla. Täten saadaan liuoksessa läsnä olevat liuenneen aineen moolit.
Sitten liuenneen aineen moolit säädetään jokaista muodostunutta 1000 grammaa liuosta kohti laskentaperusteena ja siten saadaan molaalisuusyksiköt: moolia liuenneita aineita / 1000 g liuosta Liuotin
1.- Liuokselle, joka sisältää 1000 g mineraaliliuotinta ja 36 grammaa magnesiumhydroksidia [Mg (OH)2] ja jos magnesiumhydroksidin molekyylipaino on 58 g / mol.

2.- Liuokselle, joka sisältää 2000 g mineraaliliuotinta ja 42 grammaa kalsiumhydroksidia [Ca (OH)2] ja jos kalsiumhydroksidin molekyylipaino on 74 g / mol.
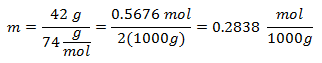
3. - Liuokselle, joka sisältää 3000 g mineraaliliuotinta ja 28 grammaa natriumkloridia (NaCl) ja jos natriumkloridin molekyylipaino on 58 g / mol.

4. - Liuokselle, joka sisältää 5000 g mineraaliliuotinta ja 13 grammaa kalsiumkloridia (CaCl2), ja jos kalsiumkloridin molekyylipaino on 110 g / mol.

5.- Liuokselle, joka sisältää 10000 g mineraaliliuotinta ja 96 grammaa natriumsulfaattia (Na2SW4), ja jos natriumsulfaatin molekyylipaino on 142 g / mol.

Liuottimääriä käsitellään 1000 g: n kerrannaisina, jotta 1000 grammaa jätettäisiin vertailukohteeksi eikä niitä oteta huomioon, mikä vaikuttaa laskentaan.
Esimerkkejä normaaluudesta
Normaalisuus osoittaa, kuinka monta aineekvivalenttia on litraa täydellistä liuosta. Normaalisuus on toinen kemian yksikkö, jota käytetään eniten nestemäisiä liuoksia varten, kun tehdään tilavuusanalyysiä. Se on merkitty kirjaimella "N".
Ekvivalentti on yksikkö, joka saadaan jakamalla liuenneen aineen grammat (g) sen ekvivalentilla painolla (pieni). Ekvivalenttipaino (Peq) syntyy jakamalla molekyylipaino (PM) aktiivisella Valencialla (*), mikä on helpompi havaita hapoissa ja emäksissä. Esimerkiksi aktiivinen kloorivetyhapon Valencia (HCl) on 1; aktiivinen kalsiumhydroksidin Valencia [Ca (OH)2] on 2 johtuen vety (H +) ja hydroksyyli (OH-) ioneista, joita kukin niistä esittää.
Sitten liuenneet ekvivalentit jaetaan liuos litroilla, ja näin saadaan normaaliuden yksiköt: liuenneet ekvivalentit / liuos litraa.
1. - Liuokselle, jossa on 0,5 litraa magnesiumhydroksidia [Mg (OH)2] ja jos magnesiumhydroksidin molekyylipaino on 58 g / mol. Sinulla on 36 grammaa sitä.

2. - 1 litran kalsiumhydroksidiliuokselle [Ca (OH)2] ja jos kalsiumhydroksidin molekyylipaino on 74 g / mol. Sinulla on 42 grammaa sitä.

3.- Liuokselle, jossa on 3 litraa natriumkloridia (NaCl) ja jos natriumkloridin molekyylipaino on 58 g / mol. Sinulla on 28 grammaa sitä.

4.- Liuokselle, jossa on 5 litraa kalsiumkloridia (CaCl2), ja jos kalsiumkloridin molekyylipaino on 110 g / mol. Sinulla on 13 grammaa sitä.
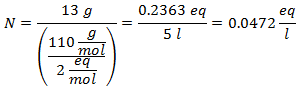
5.- Liuokselle, jossa on 10 litraa natriumsulfaattia (Na2SW4), ja jos natriumsulfaatin molekyylipaino on 142 g / mol. Sinulla on 96 grammaa sitä.

Esimerkkejä painoprosentista
Painoprosentti on lauseke Pitoisuus, joka syntyy jakamalla Liuoksen määrä grammoina kokonaisliuoksen välillä. Saatuaan desimaalimäärän se kerrotaan 100: lla ja ilmaistaan symbolilla "%". Tätä yksikköä käytetään yleensä pitoisuuksien mittaamiseen kiinteissä tai rakeisissa seoksissa.
1. - seos, jossa on yhteensä 1300 g, sisältää 13 g kalsiumkarbonaattia. Painoprosentti on:

2.- 100 g: n seos sisältää 26 g sokeria. Painoprosentti on:

3. - 250 g: n seos sisältää 60 g natriumkloridia. Painoprosentti on:

4. - 800 g: n seos sisältää 150 g kalsiumhydroksidia. Painoprosentti on:

5.- 1500 g: n seos sisältää 10 g natriumbikarbonaattia. Painoprosentti on:
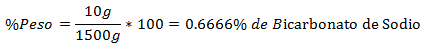
Esimerkkejä tilavuusprosentista
Prosenttiosuus tilavuudessa on lauseke Pitoisuus, joka syntyy jakamalla määrä liuenneen aineen tilavuusyksikköinä jaettuna kokonaisliuoksen tilavuudella. Saatuaan desimaalimäärän se kerrotaan 100: lla ja ilmaistaan symbolilla "%". Tätä yksikköä käytetään yleensä pitoisuuksien mittaamiseen nestemäisten tai kaasumaisten komponenttien seoksissa.
1.- Seos 1300 ml: n kokonaismäärästä sisältää 130 ml etanolia. Määräprosentti on:

2.- 100 ml: n seos sisältää 26 ml glyseriiniä. Määräprosentti on:

3.- 250 ml: n seos sisältää 60 ml etyylieetteriä. Määräprosentti on:

4.- 800 ml: n seos sisältää 150 ml glykolia. Määräprosentti on:

5. - Seos, jossa on yhteensä 1500 ml, sisältää 10 ml heksaania. Määräprosentti on: