Hvad er elektrolyse
Kemi / / July 04, 2021
I kemi, Elektrolyse er det fænomen, hvor en elektrisk strøm løber gennem en vandig opløsning af en ionisk forbindelseog starter diriger ionerne (ladede partikler) af forbindelse a to elektroder, positiv (Anode, tiltrækker negativt ladede anioner) og negativ (Katode, tiltrækker positivt ladede kationer). Dette fænomen er underlagt loven om elektrostatik, som indikerer, at modsatte ladninger tiltrækker hinanden.
Elektrolytter
I 1883 Michael Faraday opdagede, at vandige opløsninger af visse stoffer leder elektrisk strøm, mens opløsninger af andre stoffer ikke gør det.
For at teste, om en vandig opløsning leder elektrisk strøm eller ej, designet Faraday et simpelt apparat bestående af en 110 volt jævnstrømskredsløb, en lampe, Y to metal- eller grafitelektroder er tilsluttet til den aktuelle kilde.
Hvis elektroderne nedsænkes i vand, er strømmen så lille, at lampen ikke lyser. det samme gælder, hvis de dyppes i en sukkeropløsning.
Tværtimod, hvis de er nedsænket i en løsning af Natriumchlorid NaCl
eller fra Saltsyre HCl, lampen skinner stærkt, hvilket beviser, at opløsning er en fremragende leder. På den anden side ved anvendelse af eddikesyre CH3Koncentreret COOH leder opløsningen dårligt, men når syren fortyndes med vand H2Eller dens elektriske ledningsevne øges.Under strømmen gennem forskellige løsninger opnås forskellige produkter ved elektroderne.
I løbet af sine studier om elektrolyse udledte Faraday følgende love:
1. lov: Mængden af stof, der har sin kemiske transformation i en elektrode, er proportional med den mængde elektricitet, der passerer gennem opløsningen.
2. lov: Hvis den samme mængde elektricitet ledes gennem forskellige løsninger, er stoffernes vægt nedbrudt eller afsat på de forskellige elektroder er proportional med den ækvivalente vægt af nævnte stoffer.
For at nævne et eksempel:
Det antages, at du har fem forskellige elektrolytiske celler. Den første med Saltsyre HCI, den anden med Kobbersulfat CuSO4, den tredje med Antimonious Chloride SbCl3, den fjerde med Tannklorid SnCl2 og den femte med Stannic Chloride SnCl4.
Den samme strøm føres gennem en række elektrolytiske celler, indtil 1.008 gram brint (a Ækvivalent vægt af hydrogen) af saltsyreopløsningen, vægten (i gram) af de andre produkter frigivet på samme tid De er:

Det Ækvivalent vægt har værdien af Elementets atomvægt divideret med elementet Valencia.
For at frigive en tilsvarende vægt af ethvert element, har du brug for 96500 Coulombs. Denne mængde elektricitet kaldes 1 Faraday.
Faraday-enheden
Ampere defineres som en ensartet strøm, der afsætter 0,001118 gram sølv (Ag) fra en opløsning af sølvnitrat (AgNO3) om et sekund. Da sølvets atomvægt er 107,88 g / mol, forholdet 107,88 / 0,001118 giver antal ampere-sekunder eller Coulombs krævet elektricitet at deponere en kemisk ækvivalent med sølv. Denne mængde er 96494 Coulombs (96500-værdien er ganske omtrentlig for enklere beregninger) og kaldes 1 Faraday of Electricity.
Elektroder
Faraday ringede Anode til positiv elektrode og katode til negativ elektrode. Han skabte også udtrykkene Anion og Kation, anvendt på stoffer, der vises henholdsvis ved anoden og ved katoden under elektrolyse.
I øjeblikket er en anden definition for elektroder:
Anode: Elektrode, hvor der er tab af elektroner eller oxidation.
Katode: Elektrode, hvor der er elektronforstærkning eller -reduktion.
Elektrolytter og ikke-elektrolytter
Ledningen af elektrisk strøm gennem løsninger blev ikke tilfredsstillende forklaret før 1887, da Svante Arrhenius gjorde sin teori kendt. Før vi værdsatte og forstod Arrhenius-teorien, skitserede vi først nogle af de fakta, som videnskaben kendte, da Arrhenius formulerede den:
Det Ikke-elektrolytløsninger de har egenskaber, der kan beregnes ved at anvende Raoults lov. Damptrykket og de observerede kogepunkter og frysepunkter for disse opløsninger er praktisk talt de samme som de beregnede værdier.
Det Raoults lov forklarer, at damptrykket for hver opløsningsmiddel i opløsning afhænger af dets egen molfraktion i det, ganget med dets damptryk i ren tilstand.

Raoults lov mislykkes, når den anvendes på elektrolytløsninger i vand. Variationerne i damptryk og kogepunkter og frysepunkter er altid større end dem, der er forudsagt af ovennævnte lov, og øges desuden, når de fortyndes.
Sådanne afvigelser er repræsenteret af værdien i, som er forholdet mellem variationen observeret i frysepunktet mellem variationen beregnet i frysepunktet:

Værdien af i er et mål for afvigelsen fra Raoults lov og er lig med 1, når der ikke er nogen afvigelse.
Elektrisk ledningsevne af elektrolytter
Arrhenius undersøgte ledningsevnen af vandige elektrolytopløsninger for at finde ud af, hvordan ledningsevnen varierede med elektrolytkoncentrationen.
Den målte molær ledningsevne (som er den ledningsevne, der svarer til en mol opløst elektrolyt; det vil sige den specifikke ledningsevne henvist til en mol og fandt ud af, at den steg med fortynding.
Arrhenius sammenlignede sine resultater med målinger af afvigelser fra Raoults lov og fandt et tæt forhold mellem disse og molær ledningsevne. I hans teori forklares elektrolytternes opførsel:
”Elektrolytmolekylerne adskiller sig i elektrisk ladede partikler kaldet ioner. Opløsningen er ufuldstændig, og der er en ligevægt mellem molekylerne og deres ioner. Ionerne leder strømmen, når de bevæger sig gennem løsningen ”.
Afvigelser fra Raoults lov skyldes stigningen i antallet af partikler, der skyldes den delvise dissociation af molekylerne.
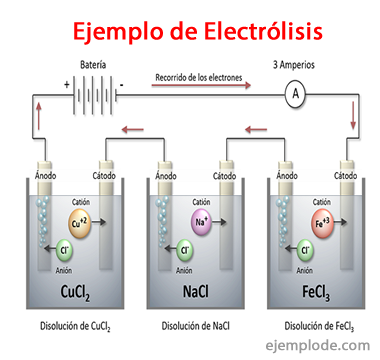
Eksempler på elektrolyse
Nogle løsninger, der opfører sig som elektrolytter, dvs. de har kapacitet til elektrolyse er:
Natriumchlorid NaCl
Saltsyre HCI
Natriumsulfat Na2SW4
Svovlsyre H2SW4
Natriumhydroxid NaOH
Ammoniumhydroxid NH4Åh
Natriumcarbonat Na2CO3
Natriumhydrogencarbonat NaHCO3
Salpetersyre HNO3
Sølvnitrat AgNO3
Zinksulfat ZnSO4
