Eksempel på kovalent binding
Kemi / / July 04, 2021
Det Kovalent binding er den, hvori to atomer forenes ved at dele deres elektroner, for at fuldføre dine Octet-regler.
Historien om den kovalente obligation
Det var i begyndelsen af det 20. århundrede, at kemikere begyndte at forstå, hvordan og hvorfor molekyler blev dannet. Det første store gennembrud kom med forslaget om Gilbert Lewis om hvad dannelsen af en kemisk binding antyder det atomer deler elektroner. Lewis beskrev dannelsen af en kemisk binding i brint som:

Denne type elektronparring er et eksempel på en kovalent binding, en binding, hvori to elektroner deles af to atomer. Det Kovalente forbindelser De er det indeholder kun kovalente bindinger.
Elektroner i den kovalente binding
For enkelhedens skyld er delt elektronpar er ofte repræsenteret som enkelt linje forbinder elementernes symboler. Således er den kovalente binding af hydrogenmolekylet skrevet som H-H.
I den kovalente binding, hver elektron af det delte par er tiltrukket af kernerne i begge atomer. Denne attraktion holder de to atomer i H-molekylet sammen.
2 og det er ansvarligt for dannelsen af kovalente bindinger i andre molekyler.I de kovalente bindinger mellem atomer på flere elektroner kun valenselektroner deltager, som er den yderste, i den laveste kredsløb. Mellem en og tre af dem vil deltage i fagforeningen.
De andre elektroner, der ikke deltager i bindingen, kaldes Ikke-bindende elektroner, eller hvis vi organiserer dem parvis, Gratis par. Det vil sige, par Valencia-elektroner det ikke deltage i dannelsen af kovalent obligation.
Kovalent obligationsrepræsentation
Strukturerne, hvormed kovalente forbindelser er repræsenteret, såsom H2 og F2 er kendt som Lewis strukturer. En Lewis-struktur er en repræsentation af en kovalent binding, hvor parret af delte elektroner angivet med linjer eller som par af punkter mellem to atomer, og ikke-delte gratis par er angivet som par af punkter på de enkelte atomer. I en Lewis-struktur vises kun valenselektronerne og ikke de interne.
I betragtning af Lewis-strukturen for vandmolekylet H2Eller alle valenselektronerne i hydrogen- og iltatomerne markeres først med prikker.
I et andet tilfælde er linket markeret med en linje. Og de gratis par, som kun vil eksistere i ilt, med point.
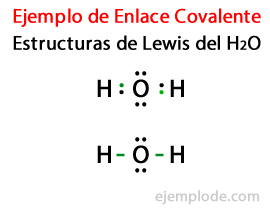
Oktetens regel
Dannelsen af disse molekyler, ligesom dem af vand H2Eller illustrer opkaldet Oktetregel, foreslået af Lewis: Et andet atom end brint har tendens til at danne bindinger, indtil det omgiver sig med otte valenselektronerDet vil sige, at der dannes en kovalent binding, når der ikke er nok elektroner til hvert enkelt atom til at fuldføre sin oktet.
Ved at dele elektroner i en kovalent binding, hvert atom fuldender sin oktet. For brint er kravet, at du får den elektroniske konfiguration af Helium, som skal have i alt to elektroner.
Oktetreglen fungerer hovedsageligt for elementerne i anden periode eller række i det periodiske system. Disse elementer har underniveauer, hvor der i alt kan være otte elektroner.
Når et atom af disse grundstoffer danner en kovalent forbindelse, opnår den den elektroniske konfiguration af neon ædelgas og deler elektroner med andre atomer i den samme forbindelse.
Typer af kovalente obligationer
Atomer kan danne forskellige typer kovalente obligationer: Singler, dobbelt eller tredobbelt.
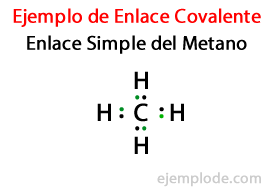
I en Simpelt link, to atomer er forbundet ved hjælp af Et par elektroner. De forekommer i langt størstedelen af kovalente forbindelser, og det er den mest basale form for denne binding.
I mange forbindelser Dobbeltkoblinger, det vil sige, når to atomer deler To par elektroner. Hvis to atomer deler to par elektroner, kaldes den kovalente binding en dobbeltbinding. Disse bindinger findes i molekyler som kuldioxid (CO2) og ethylen (C2H4).

EN Triple Link opstår, når to atomer deler Tre par elektronersom i kvælstof N-molekylet2Acetylen C-molekylet2H2.

Flere bindinger er kortere end enkelt kovalente bindinger. Det Linklængde er defineret som afstand mellem kernen i to sammenføjede atomer ved en kovalent binding i et molekyle.
Forskelle mellem kovalente og ioniske forbindelser
Ioniske og kovalente forbindelser udviser markante forskelle i deres generelle fysiske egenskaber på grund af det faktum, at deres bindinger er af forskellig art.
I Kovalente forbindelser eksisterer to typer af attraktive kræfter; en af dem er den der holder atomerne i et molekyle sammen. Et kvantitativt mål for denne attraktion er bindende energi. Den anden tiltrækningskraft fungerer mellem de komplette molekyler og kaldes Intermolekylær kraft. Da intermolekylære kræfter normalt er svagere end kræfterne, der holder atomerne i et molekyle sammen, binder molekylerne i en kovalent forbindelse med mindre kraft.
I consecuense, kovalente forbindelser er næsten altid lavtsmeltende gasser, væsker eller faste stoffern. På den anden side de elektrostatiske kræfter, der holder ionerne sammen i en ionisk forbindelse er de normalt meget stærke, således at ioniske forbindelser er faste ved stuetemperatur og har høje smeltepunkter. Mange ioniske forbindelser er opløselige i vand, og deres vandige opløsninger leder elektricitet, fordi disse forbindelser er stærke elektrolytter.
Det meste af kovalente forbindelser er uopløselige i vand, og hvis de opløses, dets vandige opløsninger som sædvanligt de leder ikke elektricitet fordi disse forbindelser er ikke-elektrolytter. Smeltede ioniske forbindelser leder elektricitet, fordi de indeholder kationer og anioner, der bevæger sig frit; flydende eller smeltede kovalente forbindelser leder ikke elektricitet, fordi der ikke er nogen ioner til stede.
Eksempler på kovalent bundne forbindelser
- Acetylen C2H2
- Methan CH4
- Ethan C2H6
- Propan C3H8
- Butan C4H10
- Benzen C6H6
- Toluen C7H8
- Methylalkohol CH3Åh
- Ethylalkohol C2H5Åh
- Propylalkohol C3H7Åh
- Methylether CH3OCH3
- Methylethylether C2H5OCH3
- Ethylether C2H5OC2H5
- Myresyre HCOOH
- Eddikesyre CH3COOH
- Propionsyre C2H5COOH
- Smørsyre C3H7COOH
- Kuldioxid CO2
- Kulilte CO
- Molekylært kvælstof N2
- Molekylært hydrogen H2


